Research
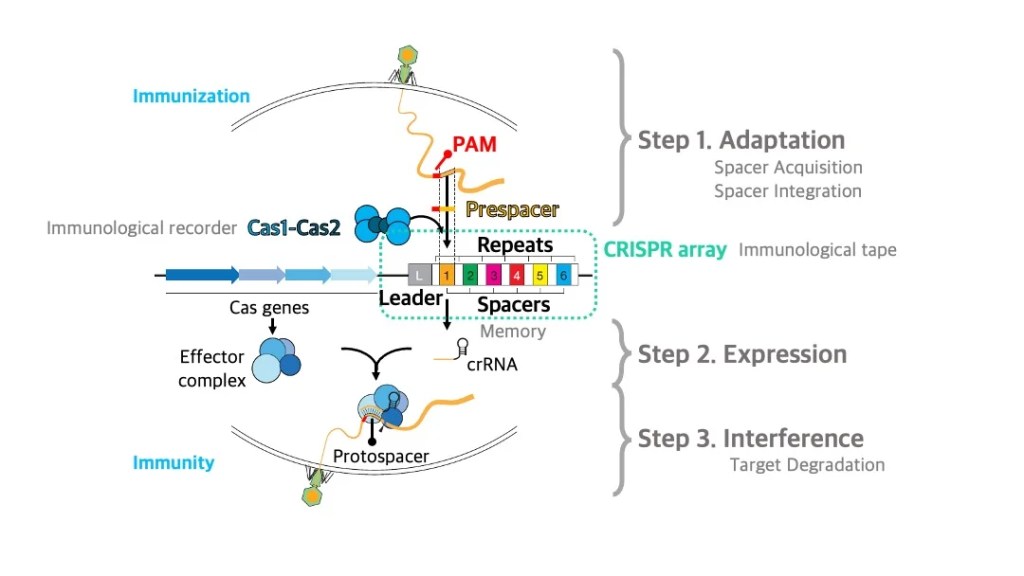
CRISPR-Cas Biology
CRISPR adaptation
RNA-related CRISPR systems
Novel CRISPR technologies
CRISPR-Cas is the prokaryotic adaptive immune system that plays a crucial role in protecting bacteria and archaea from invading viruses and plasmids. This fascinating system not only serves as a defense mechanism but also offers unique insights into the fundamental mechanisms of genetic editing. We focus on the intricate workings of CRISPR-Cas systems, exploring how they recognize and eliminate foreign genetic material while retaining memory of past infections. Additionally, we investigate novel applications of this technology, including its transformative potential in medicine, agriculture, and environmental science, which could revolutionize the way we approach genetic modifications and therapeutics.
CRISPR-Cas는 원핵생물의 후천성 면역 체계입니다. 이 시스템은 특정 박테리아와 고세균이 외부의 바이러스로부터 자신을 방어하기 위해 진화해 온 독특한 메커니즘을 포함하고 있습니다. 저희 연구 그룹은 다양한 종류의 CRISPR-Cas 체계들의 기본적인 원리 규명에 기반한 응용 연구에 초점을 맞추고 있습니다. 특히, 우리는 이 시스템이 유전자 편집 기술에 어떻게 활용될 수 있는지를 탐구하고 있으며, 그 과정에서 생물학적 이해를 넓히고 보다 효과적이고 안전한 유전자 조작 방법을 개발하는 것을 목표로 하고 있습니다. 이를 통해 농업, 의학 및 생명공학 분야에서 새로운 가능성을 열고자 합니다.
Host-Virus Interaction
Human RNA viruses
Human DNA viruses
Human immune regulation
Prokaryotic immunity
We study on basic mechanisms of replication, pathogenesis and mutagenesis of human viruses, including coronaviruses (e.g. SARS-CoV-2), human herpesviruses (e.g. HCMV), and prokaryotic viruses (Bacteriophages). Our research delves into the intricate processes that govern how these viruses replicate within host cells, thus contributing to their ability to spread and cause disease. By examining the factors that influence viral pathogenesis, we aim to uncover the specific interactions between viral components and host immune responses, which are often complex and multifaceted. Furthermore, we explore how various environmental triggers, genetic predispositions, and co-infections may modulate these interactions, potentially leading to more severe disease outcomes. Moreover, our investigation into mutagenesis focuses on how genetic variations in these viruses occur and how they may impact their evolution and adaptability, particularly in response to antiviral therapies. This includes studying the mechanisms by which mutations arise and how they can confer advantages such as increased virulence or resistance to treatments. This comprehensive approach allows us to better understand not only the biology of these viruses but also their implications for public health and disease prevention, emphasizing the crucial need for ongoing research in this area. Through our findings, we hope to contribute valuable insights into the development of effective vaccines and therapeutic strategies tailored to combat these viral infections. Additionally, we recognize that a better understanding of these processes can inform policies and practices aimed at enhancing global health security, ultimately improving health outcomes on a global scale and equipping societies to better respond to future viral threats.
저희 연구 그룹은 코로나바이러스 및 인간헤르페스바이러스, 박테리오파지를 포함하는 다양한 종류의 바이러스들의 복제 및 발병 과정, 변이 과정에 관련된 기초적 사실을 규명하는 연구를 하고 있습니다. 이를 통해 바이러스의 생물학적 특성뿐만 아니라 이들이 인간 건강에 미치는 영향을 심층적으로 이해하고자 하며, 특히 새로운 치료법 개발을 위한 중요한 기초 자료를 제공할 수 있도록 노력하고 있습니다. 또한, 이러한 연구는 백신 개발 및 공중보건 전략 수립에도 기여할 것으로 기대하고 있습니다. 지금 이 시점에서 바이러스 연구의 중요성은 더욱 커지고 있으며, 우리는 변화하는 바이러스 환경에 맞춰 진화하는 과학적 접근법을 지속적으로 모색하고 있습니다.
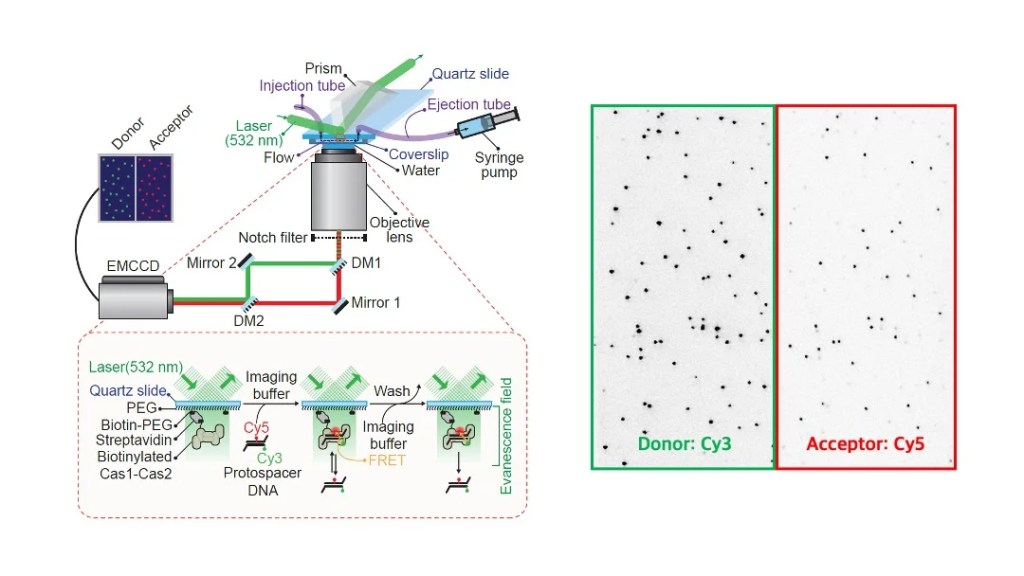
Single-molecule Biophysics
Single-molecule FRET
Single-molecule TIRF microscopy
Super-resolution imaging
Our group has extensive expertise in the single-molecule fluorescent imaging technique, which has revolutionized the way we observe and understand molecular interactions at a fundamental level. Single-molecule FRET (Förster Resonance Energy Transfer) is a sophisticated biophysical technique that is predominantly utilized to measure distances at several nanometer scales within a single molecule, allowing researchers to gain insights into molecular dynamics that were previously difficult to achieve. This remarkable property can be mainly employed as a highly precise molecular ruler or to elucidate the dynamic molecular structures and intricate interactions that govern biological processes. The main advantage of using TIRF (Total Internal Reflection Fluorescence) microscopy lies in its exceptional spatio-temporal resolution, which is significantly higher compared to traditional epifluorescent microscopy, as it visualizes only surface-immobilized molecules and minimizes the background fluorescence from the bulk solution. By carefully utilizing the photophysical properties associated with photobleaching phenomena, in conjunction with FRET techniques, we can comprehensively study diverse aspects of molecular interactions, including molecular stoichiometry, transient binding events, and the co-localization of proteins and nucleic acids, thus providing deeper insights into the mechanisms underlying cellular functions and interactions. This methodology serves as a powerful tool in the field of molecular biology, facilitating significant advancements in our understanding of complex biological systems.
저희 연구 그룹은 단일-분자 형광 이미징 기술에 전문성을 가지고 있습니다. 단일-분자 FRET이라는 생물물리학적 기법을 활용하여 단일-분자 수준에서의 수 나노미터 정도의 거리 변화를 측정하여 분자적 거리 측량 혹은 역동적 분자 구조와 상호작용의 변화를 관찰하고 있습니다. TIRF 현미경 기법의 사용상 최대 장점은 일반적인 에피형광현미경법들에 비해 매우 좋은 신호-대-잡음 비율을 가지고 있다는 것입니다. 이는 형광 여기 작용이 바닥에 붙은 분자들에서만 일어나는 것에서 기인한 것으로 광표백 현상이나 FRET과 같은 생물물리학적 특성들과 결합하여, 저희 연구 그룹에서는 분자적 상호작용, 분자 화학량론, 그리고 단백질과 핵산 분자들의 일시적 결합과 공존 현상 등을 연구하고 있습니다. 이러한 연구는 세포 내 분자들의 복잡한 상호작용을 이해하는 데 있어서 매우 중요한 역할을 하며, 이를 통해 신약 개발이나 질병 치료에 필요한 분자 메커니즘을 밝혀내는 데 기여할 수 있습니다. 우리가 사용하는 고해상도의 이미징 기술과 접근법은 작은 스케일에서의 생물학적 현상들을 정밀하게 관찰 가능하게 하여, 이론적 모델들을 실제 실험 결과와 연결할 수 있는 기반을 마련합니다. 이를 통해 각종 생물학적 과정, 예를 들어 단백질 접힘이나 핵산의 기능적 상호작용을 좀 더 심층적으로 분석할 수 있게 됩니다.
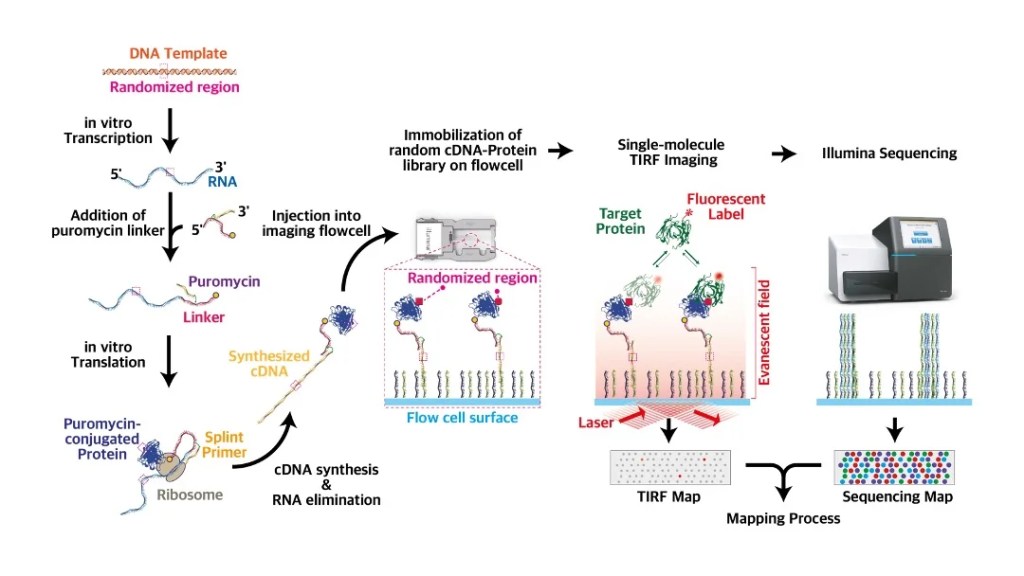
Advanced imaging technique
PepSEEK
CLICK-PAINT
Peptide-PAINT
We are developing novel techniques for high-throughput protein/peptide screening, in-cell molecular recording, and super-resolution imaging of modified nucleic acids and proteins. Conceptually, those methodologies are based on integrating the single-molecule fluorescent imaging with high-throughput sequencing, CRISPR technologies, CLICK chemistry, cutting-edge biochemistry, and bioinformatics. By harnessing the precision of these advanced techniques, we aim to enhance our understanding of complex biological systems, allowing for the identification of new biomarkers and therapeutic targets. This integrated approach not only facilitates the detailed examination of protein interactions and modifications but also supports the dynamic analysis of cellular processes in real time. Furthermore, the combination of these methodologies opens up new avenues for exploring the intricate relationships between genetic expression and cellular function, ultimately contributing to advancements in personalized medicine and targeted therapies.
저희 연구 그룹은 고처리량 단백질/펩타이드 스크리닝, 세포 내 분자 기록, 수정된 핵산 및 단백질의 초해상도 이미징을 위한 새로운 기술을 개발하고 있습니다. 개념적으로 이러한 방법론은 단일 분자 형광 이미징을 고처리량 염기서열 분석, CRISPR 기술, 클릭 화학, 최첨단 생화학 및 생물정보학과 통합하는 데 기반을 두고 있습니다. 이러한 고급 기술의 정밀성을 활용함으로써 우리는 복잡한 생물학적 시스템에 대한 이해를 향상시키고, 새로운 바이오마커 및 치료 표적의 식별을 가능하게 하고자 합니다. 이 통합 접근 방식은 단백질 상호작용 및 변형의 세부 검토를 용이하게 할 뿐만 아니라, 실시간으로 세포 과정을 동적 분석하는 것을 지원합니다. 더욱이 이러한 방법론의 조합은 유전자 발현과 세포 기능 간의 복잡한 관계를 탐구할 수 있는 새로운 길을 열어주며, 궁극적으로 개인 맞춤형 의학과 표적 치료의 발전에 기여합니다.
